過渡期を迎えた製薬企業(前編)〜ふくらむ研究開発費、上がる新薬創出のハードル

2025年問題について、その解決策や、それによって医療用医薬品サプライチェーンにどのような影響があるかなどについて、専門家に解説いただいている当企画。第1回は2025年問題の概要について、第2回は解決策として医療行政がどのような取り組みを行っているかについて、そして第3回となる今回は、医療用医薬品業界の変化についてです。前編(当記事)では、新薬の研究開発の現状についてお届けし、続く後編で、「2025年」での製薬企業のビジネスモデルについてお届けします。
◆
そもそも医薬品とは
医薬品は種類によって取り扱える職種や店舗が制限され、種類として大きく分けて二つに分けられます。ひとつは今回のテーマとなる「医療用医薬品」で、専門家である医師や薬剤師が薬の選択をおこないます。もうひとつは「一般用医薬品」で、消費者が直接、薬の選択を行います。
医療用医薬品は、特許期間がある新薬(先発品)、特許満了した新薬(長期収載品)、そして、後発医薬品(ジェネリック医薬品)、そして漢方薬等のその他に4分類できます。先発品は「特許」によって、他社が勝手に製造販売できないよう守られおり、「特許保護期間」内では先発品を開発した企業が独占販売できます。
その後、先発品の特許が満了となった後でも、開発企業は引き続き、同じ製品名で先発品の販売を続けることはできますが、便宜上、先発品から長期収載品と名称を変更します。また、特許満了後は、先発品と同等の効き目を持つ薬、ジェネリック医薬品が販売されます。ジェネリック医薬品は、新薬のような高額な研究開発費や特許登録費が必要ないことから、価格は「長期収載品」より安くなっています。すべての長期収載品にジェネリック医薬品があるとは限らず、また、症状によってはジェネリック医薬品への切り替えができない場合もあります。
「数量ベース」と「金額ベース」で大きく異なる、医療用医薬品の市場シェア
図表2は2005年度から2015年度までの数量ベースでのわが国における医療用医薬品の構成比です。2005年度では、長期収載品の構成比が最も高く、市場全体の3分の1以上を占め、2009年には市場構成比の36.3%まで上昇した後、縮小して、2015年度には26.1%まで低下しました。一方で、後発医薬品(ジェネリック医薬品)の構成比は2005年にはわずか16.7%でしたが、政府の医療費削減策の一環として後発医薬品促進策を数多く打ち出した結果、2015年には33.5%まで上昇しました。ちなみに、特許満了した新薬のうち後発医薬品が占める比率は2005年度では32.4%でしたが、2015年には56.2%まで上昇しました。政府としては、2020年9月までに、後発医薬品数量シェア80%を目指しており、その目標に対してさまざまな施策が打ち出されています。
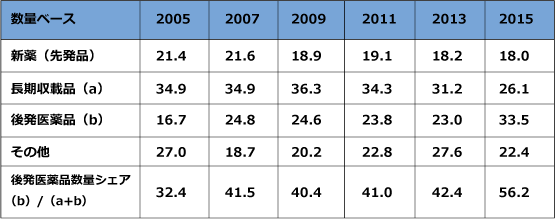
出所:厚生労働省「薬価基準改定の概要」から一部変更
金額べースでは、先発品の構成が最も高く、2005年度には47.6%、2015年度には55.9%まで上昇しました。一方で、後発医薬品の金額ベースでの割合は2005年度にはわずか5.9%でしたが、2015年には12.4%まで急成長しました。ちなみに、政府としては金額ベースでの後発医薬品シェア目標はいまのところありません。いずれにせよ、長期収載品から後発医薬品へのシフトは確実に進んでいることとなります。
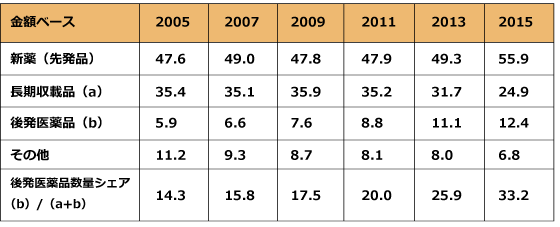
出所:厚生労働省「薬価基準改定の概要」から一部変更
したがって、日本の医療用医薬品市場において、数量ベースでは後発医薬品が構成比33.5%ともっとも高く、新薬が18%ともっとも低くなります。一方、金額ベースでは新薬構成比が圧倒的に高く55.9%、後発医薬品が12.4%と、引き続き新薬が市場でのプレゼンスを高めています。
新薬の創出には、多大な費用とリスクが伴う
それでは、新薬開発の現状はどうでしょうか。一般的に3つの開発ステージに分けられます。最初のステージの「基礎研究」では、通常2〜3年かけて新薬の候補を見つけ出します。次のステージでは、3~5年かけて、「非臨床試験」を行い、動物実験等で、薬の候補としての有効性や安全性を研究します。次に、「臨床試験」と呼ばれるステージで、人間に対して薬の候補が期待していた効果、副作用等を研究します。期間は3年から7年、場合によってはそれ以上かかることもあります。「臨床試験」には、「第1相試験」、「第2相試験」、「第3相試験」の3つの段階があります。
「第1相試験」では、主に健康な人を対象に、副作用等の安全性を確認します。安全性が確認されれば、次は投与量の設定、つまり効能と副作用のバランスの研究を「第2相試験」で行います。これまでの臨床試験は少人数で行いますが、「第3相試験」では多くの患者に対して効能と副作用とのバランス、他剤との比較等が行われます。「第3相試験」に必要な患者数は薬の効能等によっても異なり、1000人以上の症例が必要となることも多くみられます。長期間かつ多額な研究開発費をかけて、新薬として患者に投与されるためには、日本では厚生労働省に承認申請し、審査を行います。期間は一般的には1、2年以内ですが、それ以上かかることもあります。また、予期せぬ副作用等がある場合もあり、製薬企業は常に監視しています。また、薬剤によっては、投与患者の経過報告を義務付ける「第4相試験」を通過しないと、承認しないケースもあります。したがって、薬の候補が「基礎研究」から実際の「承認・販売」を経て、薬となる確率は「3万591分の1」ともいわれています 。
実際の研究開発費はどのぐらいか?
では、どのくらいの割合で研究開発費が使われているのでしょうか。公表されている2014年度の米国製薬企業の研究開発費の内訳(図表4)によると、「第3相試験」において152億ドル、次に「基礎研究および非臨床」において112億ドルが費やされています。このように、新薬を創出するには膨大な金額とリスクが伴います。また、DiMasiらの報告 では、1970年代には新薬ひとつに要した研究開発費は1970年代には179百万ドルだったのが、1980年代には413百万ドル、1990年代には1,044百万ドル、そして、2000年代には2,558百万ドル、1ドル110円で円換算すると2,814億円といわれており、1970年代と比較すると、新薬を一つ創出する費用は、14倍以上に膨れ上がったこととなります。
1 日本製薬工業協会 DATA BOOK 2012
2 DiMasi et al, Innovation in the pharmaceutical industries: New estimates of R&D costs, Journal of Health Economics, 47(20116), 20-33
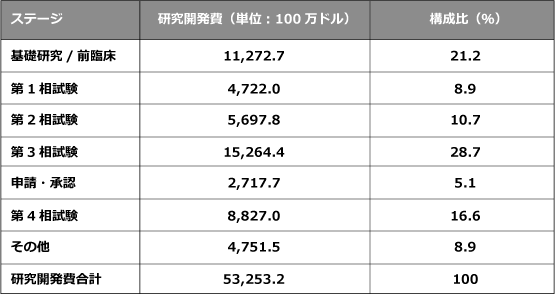
出所:PhRMA (2016) PhRMA Annual Membership Survey.
研究開発費が高騰しているが、新薬創出のハードルは高くなっている
図表5は、1995年から5年ごとの日米欧に本社を置く製薬企業の研究開発費の合計の推移です。例えば、国内製薬企業は1995年には6,422億円を研究開発費として費やし、2015年には2倍以上の1兆4,577億円まで高騰しました。特に、米国製薬企業の研究開発費は大幅に増加し、1995年には118億74百万ドルから2015年には4倍以上の470億51百万ドルとなっています。ちなみに、欧州では1995年比約3倍まで高騰しました。このように、研究開発費が高騰していますが、それに見合った新薬は創出されているのでしょうか。
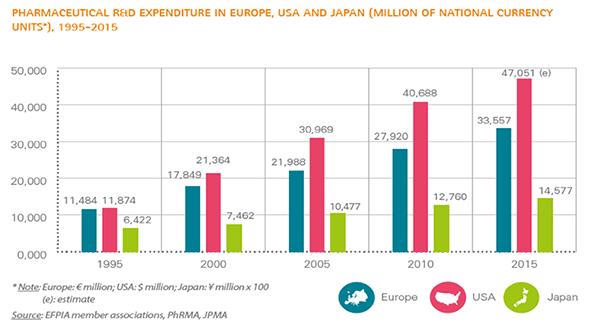
出典:European Federation of Pharmaceutical Industries and Associations
The Pharmaceutical Industry in Figures Key Data 2017
残念ながら、それに見合った成果は得られていないようです。特に、図表6からもわかるように、2002年から2011年までの期間までは低迷、いわゆる新薬創出の暗黒期でした。例えば、1997年から2001年まで製薬企業が創出した新薬数は欧州企業からは79個、米国企業からは84個、日本企業からは29個でした。その後、2007年から2011年までの創出した数はそれぞれ52個、65個、20個へと減少しました。そして、2012年から2016年までには欧州企業を除けば、1997年から2001年の水準まで超えるに改善しました。一方で、その他地域からは1997年から2001年まではわずか4個しか新薬を創出できていませんが、2007年から2011年までには12個、2012年から2016年には38個となり、この期間で初めて日本の合計新薬創出数を上回りました。高度経済成長国として、BRICsと呼ばれるブラジル、ロシア、インド、中国が一時的に注目を浴びましたが、実はこれらの国々も医療費が増加しており、製薬企業にとっても大事な販売市場でした。今後は、新薬創出国としてもBRICsへの関心が高まるでしょう。
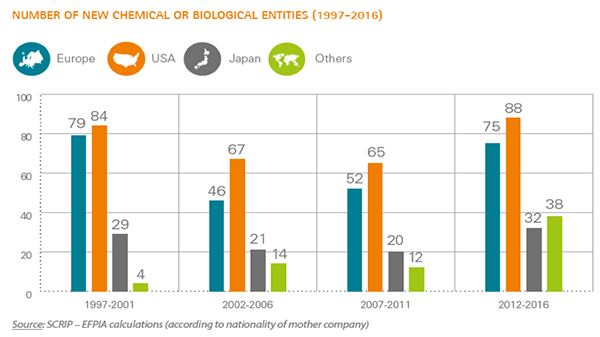
出典:European Federation of Pharmaceutical Industries and Associations
The Pharmaceutical Industry in Figures Key Data 2017
いずれにせよ、新薬創出するために費用は大幅に増加しているのにも関わらず、創出した新薬の数は増加していないため、製薬企業の研究開発生産性は低下しているといえます。製薬企業としては、投資した研究開発費を回収するために、製品価値の増大化、つまり、多くの患者数を確保するか、一剤当たりの価格を値上げするのかの選択肢しかなくなってきています。
後編はこちら:過渡期を迎えた製薬企業(後編)〜2025年に向けて新たなビジネスモデルが必要となる